创新医疗器械申报的专利策略
by 蕙识同联知识产权
创新医疗器械究竟需要什么样的专利?这是个简约而不简单的问题。
回答这个问题前,我们先看下目前医疗器械行业的整个知识产权环境。大家知晓,如今制药行业的专利侵诉权已成业内常态,不是你告我,就是我无效你,一片“繁华”景象。而同属于大医药的医疗器械行业却表现的不温不火,甚至有点儿无声无息。究其原因,可能与多个因素有关,比如:产品价值度偏低,尤其医疗器械第1、3类产品,其自身的性质决定了其市场价值度通常远不及药品;产品的可替代性强,医疗器械产品同质化严重,一种产品很难像药物一样直接垄断市场;产品生命周期短,医疗器械类产品生命周期较短,像一些“无证”产品,如LDT类产品,其生命周期通常也就几年,这几年可能都不足以支撑诉讼的周期;研发周期短,不像药品研发管线动辄十余年,医疗器械类尤其体外诊断产品的研发周期也就两三年,相比而言,短周期的风险承担能力要远高于药品;成本投入偏低,拿一个体外诊断的试剂盒为例,从立项到上市可能总投入最多也就几千万,而药品成本少则几亿,多则十几亿;行业发展刚起步,医疗器械行业尤其体外诊断这几年刚兴起,大家都自顾搭台,还无心放火。当然这里也不排除诉讼之火其实早已点燃,只是导火索还在燃烧罢了,就像博尔诚和江苏为真、以及测序仪领域纠纷等。这里要提醒广大医疗器械行业要警醒,要未雨绸缪。
正是这种现状,医疗器械人似乎不太关注侵权问题,而更多将目光投向创新医疗器械申报(以下简称创新申报)相关的专利问题,那究竟申请什么样的专利才符合创新申报呢?接下来就穿插案例,使企业明确创新申报之路上的专利功守之道。
1. 创新申报 攻之道
下表罗列了国内自创新医疗器械实施以来,已获创新批件的体外诊断类医疗器清单,这里还不包括仪器,仅涉及检测试剂盒类(截止2018年9月)。
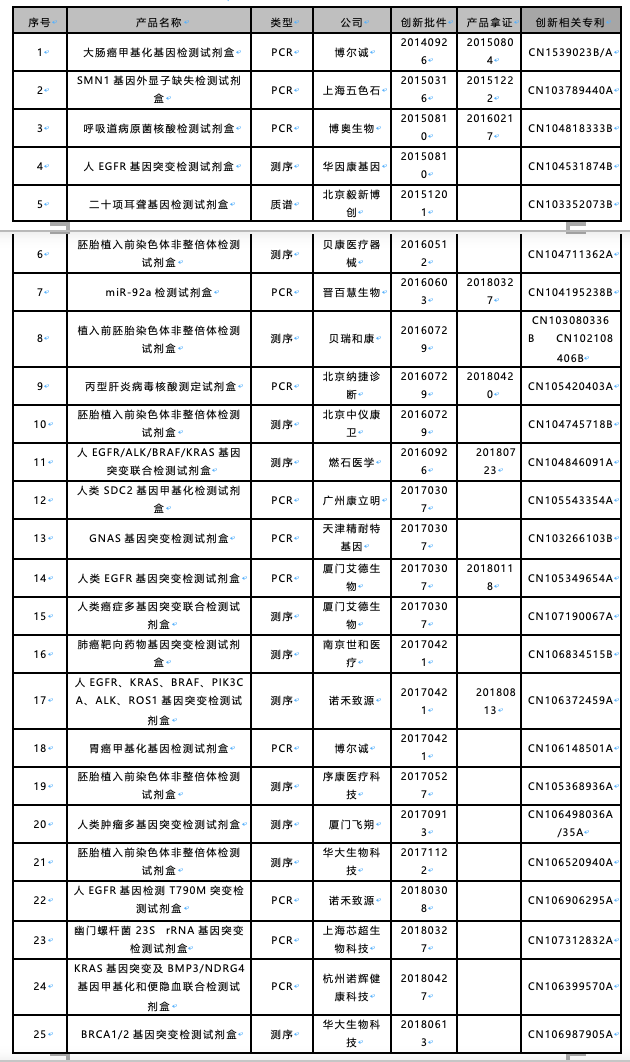
表中可见,目前25件创新批件中,在国家器械网上能够查到最终拿证的产品并不多,仅有8件,大部分尚未获批。不论最后何时获批,但说能够拿下创新批件进入绿色通道,这对于IVD企业而言就是一个莫大荣幸,极大地加速了产品的审批进度,提升了产品的审批通过率。
由于官方并不公开创新医疗器械的专利情况,笔者只能通过比对产品描述与专利技术,同时参考创新批件和专利公开时间,获得相对应的专利(如有不妥,欢迎交流)。按理来说,能够通过创新医疗器械审批的,其对应专利都应具有创新性、高价值,或者说都应被授予专利权,但实际情况并非如此,上述专利中获授权的专利并不多,抛开目前在审专利,很大一部分专利是被驳回的或主动放弃。这就说明了一个问题,所谓的创新医疗器械申报,原来并不一定需要绝对意义的创新专利。这也是企业内尤其研发人员困惑的一个问题,在他们眼里,似乎只有技术绝对创新才能去申报创新通道。那怎么来解释这个问题?
其实简单,食药监械管〔2014〕13号文规定了创新证明文件可以是在中国依法拥有产品核心技术发明专利权,但也可以是已由国务院专利行政部门公开的核心技术发明的专利申请,即既可以是专利权也可以是专利申请。之所以这么规定,是因为考虑到专利审批的长周期,而对于专利申请其只需要提供中国境内信息检索机构出具的科技查新报告或专利检索机构出具的查新报告,这个查新报告内容应可证明产品的创新点、创新水平及理由。当然,现如今政策已变:《创新医疗器械特别审批程序(修订稿)》已落地,目前的检索报告只能来自于国家知识产权局检索中心,以往的检索机构被去掉了,这从某种意义上是提升了检索报告出具的权威性。很显然现在的有利检索报告不再像以往那么容易,这就要求专利申请必须是高质量申请,在专利申请之初就应该对其进行高价值培育,而不像以往简单提交一个专利,要个公开号就能去申请创新。像上面清单中的百分之八九十都是基于专利申请而申报的创新(当时新规未落地)。但无论新规落地与否,这里需要注意的是,在创新审批期间,尽量保证专利的在审状态,被驳回或主动放弃都不行,否则就是否定创新。这期间,专利能够获得授权固然最好,即便授权有所难度,也尽量与专利局展开拉锯战,保持专利申请的悬而未决状态,毕竟有时专利局的评判标准也会有所疏漏。
至于如何在国家知识产权局专利检索咨询中心出具一份有利的检索报告,这里可能涉及到何时要求出具报告、是否对专利修改、何时进行修改等诸多问题,当然更重要的还是修炼内功,提供一份高质量的专利申请。能够处理好这些事务,只有真正谙熟专利标准和专利检索等,才能有效把握、灵活应对。
下面我们看一看近期刚拿证的几个公司是如何通过创新申报的。
2018年7月23日CFDA(现名NMPA)批准了燃石医学的高通量检测创新产品“人EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(可逆末端终止测序法)”,堪称中国首个肿瘤NGS检测试剂盒。
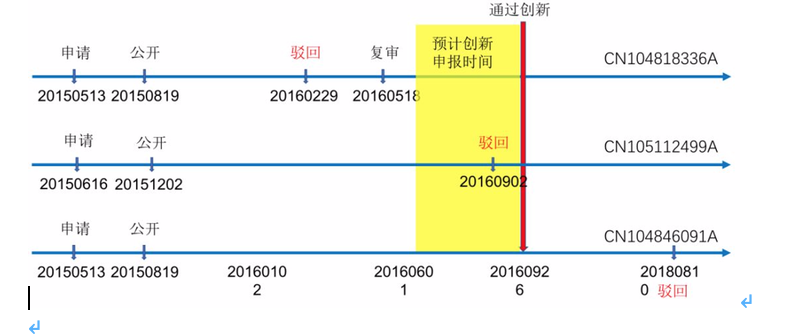
由上图看见,燃石早先其实申请了多个基于杂交捕获法联合检测人的EGFR/ALK/BRAF/ KRAS等基因突变,但不同案件的命运不同,能够用于创新申报的其实只有上图第一件CN104818336A,因为只有该专利在创新申报前处于一种在审状态,符合申报条件。相反,后两个专利CN106112499A和CN104846091A虽然也是相似技术,但由于在创新申报前就已被驳回,显然无法使用。这两个专利其实就反应了专利申请和创新申报的策略问题,具体可能涉及到时间节点的问题,即何时进行创新申报最有利?当然,在此我们先不考虑临床或GMP等其他因素,仅从专利角度而言,通常建议公司在专利公开后一个月后就尽快申报创新。首先,由于检索报告是硬性要求,因此公开后的首要问题就是找检索中心出具专利新创性的检索报告,而这个周期大约为一个月。其次,专利公开后进入实审,专利局通产在3-8个月不等的时间出具《第一次审查意见通知书》,而这个通知书的新创评述结论通常较为严格,不利于申请人;而器审创新审批的周期是2-3个月,如果创新申报较晚,稍懂专利的评审专家很可能还会参考这个通知书,可能导致不利结果。再者,如果企业自知专利的创新性可能受到专利局质疑,有被驳回风险,那专利时间上的较早公开就很可能导致较早的驳回,无异于搬石头砸自己脚。最后,专利相对较早的公开,表明专利提前进入了共有领域,公众包括竞争对手就能提早获知,那么在创新评审时,竞争对手就可以针对该专利的新创性提出不利的第三方意见。
当然了,企业在实际创新申报时要考虑的绝不仅是专利这一个因素,假如根据研发管线的进度在专利申请之初就预计创新申报会延后,那这时企业其实可以选择专利的延迟公开策略,保证在要申报创新前一个多月时再公开。像博尔诚公司2017年4月21日获批的胃癌甲基化基因检测试剂盒创新批件中的专利申请策略。

博尔诚的该专利早在2015年4月就申请,但直到2016年11月底才公开;基于博尔诚获得创新批件的时间2017年4月可以反推出创新申报应该在2017年初,可见是紧随专利公开。经进一步检索,该专利目前的法律状态,仍处于专利审查中。
一句话,尽量把握好专利公开和创新申报的时间节点,采取的手段是既可以是及早申报创新也可以延迟公开专利。
燃石医学的首个肿瘤NGS检测试剂盒获批不久,诺禾致源又于2018年8月13日获批的新产品“人EGFR、KRAS、BRAF、PIK3CA、ALK、ROS1基因突变检测试剂盒(半导体测序法)”
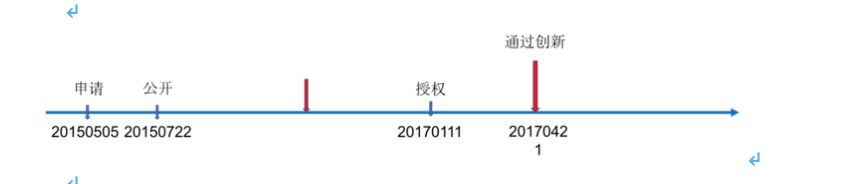
诺禾致源的案例属于典型的授权后再申请创新,这种策略是传统策略,也是最保险的策略,因为专利一旦授权,也就无需考虑太多申请策略的问题了,可以完全根据管线的进度来开展。当然了,专利授权后也可能被无效,非要考虑这种极端情况的话,对自己专利权信心不足的,也可考虑授权后尽早申报创新。另外,值得提醒的一点,现在专利加速审查通道越来越多,申请人也可以加速审查及早获得专利。
其实创新申报攻之道远不及此,再比如,当没有自有专利时,选择受让或独家被许可也是可快速走上创新申报之路的捷径,因为这也符合食药监械管规定。像博尔诚的另一件审批大肠癌甲基化基因检测试剂盒的专利CN1539023B,以及北京中仪康卫的胚胎植入前染色体非整倍体检测试剂盒的专利CN104745718B都是通过受让而来。
在这里,不得不再提一下博尔诚公司,因为博尔诚可以说是打开了中国体外诊断类创新医疗器械的先河,早在2013年,博尔诚就以独占许可的方式获得了专利CN1539023B的独占权,随后于2014年9月获得了“大肠癌(Septin9基因)甲基化基因检测试剂盒”的创新通道,紧接着2015年8月即获得了该产品的上市批件,可谓一帆风顺。但与此同时国内的江苏为真等四家公司也在研究相同的技术并着手上市申报,当博尔诚得知该信息后,当然当仁不让,体现了强烈的专利保护意思。于是,在2017年6月对江苏为真等四家公司提出了专利侵权诉讼,试图通过法律手段阻止其侵权行为,进而维护自身的合法权益。博尔诚的这个通过专利诉讼遏制侵权的行为是专利权人最有效且最有力的专利攻之道。
此外,创新申报时专利的选择匹配也很重要,首先,专利与申报产品必须有相关性,但又不必完全一致。就像检测EGFR基因突变的创新申报就不一定完全针是对EGFR的专利,有时平台专利也是不错的选择,像上面提到的博尔诚的CN1539023B即是一种平台专利。
2. 创新申报 守之道
有攻必有守,江苏为真在面临博尔诚的进攻时就展现出有效的防守之道。在这个诉讼中,江苏为真为了自己的医疗器械上市之路必须坚守自己的防线。诉讼中,江苏为真并未采取死守,而是以守转攻还以颜色。他们通过向专利局提出无效宣告,进而挑战博尔诚核心专利CN1539023B的创新性。最终专利局支持了江苏为真,否定了博尔诚的专利创新性,将其拉下神坛。于是江苏为真的“人septin9基因甲基化检测试剂盒”也在今年3月份顺利上市。可见专利无效策略是面临诉讼进攻时很有利的被动守之道。
被动的防守毕竟被动,这里谈谈如何主动防守,笔者认为,与其担忧医疗器械申报时被动诉讼,还不如在立项之初,就做好扎实的专利检索与分析工作,及时规避设计;在专利申请时做好扎实的专利撰写工作,保障自己的合法知产权益。只有前期未雨绸缪,日后方能立于不败,这可能是最好的守之道。
无论是被动还是主动,专利守之道是创新医疗器械审批过程中一个不容忽视的环节,望企业及早重视,免于危患。
3. 无论是攻之道还是守之道,其实最核心的还是专利的质量,一个经得起推敲的高质量专利是即能攻又能守。作为知产人,我们呼吁创新医疗器械的专利最好且必须是高价值专利,培育高质量专利,企业除了拥有良好的技术外,还需注意以下几点:
第一,检索式高价值专利撰写。高价值专利的种类有很多,这里的高价值专利并不一定是绝对垄断意义的专利,也不一定是范围无懈可击的专利,更多可能是一个具有绝对新创性的专利,这种新创性要能对抗查新检索。因此,这类专利在撰写前期要经过周严的专利检索,或叫查新检索。只是这里的查新检索应更加深刻更加周严,以保万无一失。说到这里,可能大家会问,什么意思,难道一个查新检索还有多种层次?还分三六九等?回答是肯定的,不同的检索员,不同的检索数据库,不同的检索时间,不同的检索深度都会导致不同的检索结果甚至不同的检索结论,这也是为什么有些专利在多年之后才被无效掉,或者有的代理所或咨询机构能够找到无效证据,而有的不能。所以我们说检索很重要,找到一个专业的检索机构更重要,而现在很多提供的查新检索往往流于形式,难于对抗后期检索或专利审查,企业需要注意区分。
第二,选择一个靠谱的代理机构。代理机构最好具备一定创新医疗器械经验,这里不仅是指代理机构代理过医疗器械的案件,更好是了解创新医疗器械申报的法规等。只有熟悉流程,才能写出一个真正符合创新申报的专利,比如核心度的考量,权利要求类型的考量,各时间节点的把握等。否则很容易在后期过程中离申请人的需求越来越远,最后拖慢或搁浅整个申报节奏,这就得不偿失。
第三,支付一个靠谱的代理费。我们要明白,现在创新申报的专利价值真不比药企化合物专利的价值低,对于这样的专利撰写,不宜一味追求价格便宜,便宜的代价往往是拿到个不利的检索报告,专利容易被驳回等。
第四,流程时间节点的把握。创新申报无非为了注册报批更快更稳,如果创新申报折腾的时间严重拖慢进度,那就失去意义。因此,对于创新申报的时间及时间节点要有可控把握,这里的把握包括但不限于:申请时机的把握,公开时机的把握,检索时机的把握,审查节奏的把握等,当然这里更多的体现的是加速,企业可合理选择不同的加速途径。
第五,不利检索报告应对。现在由检索中心出具的报告虽然增加了报告的权威性,但也不排除偶尔出具有争议的检索报告,事实上这种情况也比较常见。原因很简单,这里无非对错,因为无论是专利审查员还是专利检索员,他们其实都是假定的本领域技术人员,再加上创新技术自身的前沿特性,容易使检索员在对创造性评判时把握不那么准确,进而可能出具一个不具备创造性的检索报告。对于这样的报告我们怎么去处理,是申请报告时进行预处理?还是报告出具后的质量反馈?这些都是值得深思且应该未雨绸缪的,企业需要格外重视。
最后,蕙识咨询有着丰富的医疗器械类高价值专利培育经验,蕙识的初衷就是提供最高质量、最专业的知识产权服务。欢迎交流指导!






 11011502003002
11011502003002